Азотная кислота – активное вещество, используемое в промышленности и лаборатории. Ее можно получить путем окисления азота из электролита.
Электролиты – вещества, диссоциирующие в ионы при растворении в воде. Одним из таких электролитов является серная кислота (H2SO4), используемая в процессе получения азотной кислоты.
Для получения азотной кислоты из электролита необходимо выполнить несколько простых шагов. Сначала приготовьте раствор серной кислоты, добавив воду к концентрированной серной кислоте. Затем, при низкой температуре, добавьте азотную кислоту в раствор. В результате добавления азотной кислоты происходит процесс окисления:
H2SO4 + HNO3 → 2NO2 + H2O + SO2
В результате окисления образуется двуокись азота (NO2), которая является азотной кислотой. Важно помнить, что этот процесс следует проводить очень осторожно, поскольку азотная кислота является ядовитым веществом и может быть опасна для здоровья.
Выбор подходящего электролита
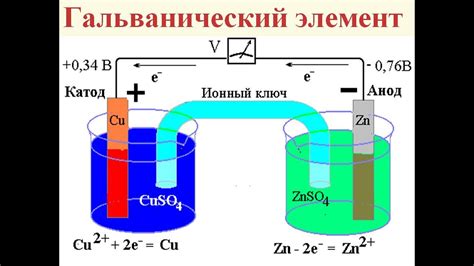
Электролиты помогают ионам двигаться во время электролиза, ускоряя реакцию. Для получения азотной кислоты используйте сильные кислоты, например серную или хлорную.
Важно учитывать стабильность электролита. Он должен быть устойчив к электрическим реакциям, без опасных отходов.
Выбирайте электролит с учетом его концентрации. Оптимальная концентрация зависит от типа проводимости и скорости реакции. Для кислот обычно используют концентрацию 30-50%.
При выборе электролита для процесса получения азотной кислоты важно учитывать его проводимость и химическую стабильность, а также определить оптимальную концентрацию.
Очистка электролита от примесей
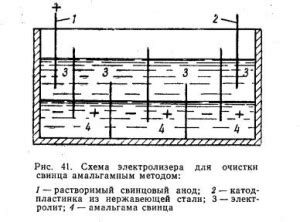
Для обеспечения высокой чистоты электролита и исключения нежелательных примесей при производстве азотной кислоты можно применить фильтрацию или дистилляцию.
Фильтрация с использованием специальных фильтров поможет удалить механические примеси и другие частицы из электролита.
| Фильтрация | Применение специальных фильтров для удаления примесей и частиц |
| Дистилляция | Обработка электролита при нагревании и конденсации паров для получения чистого вещества |
| Контроль pH и проводимости | Использование pH-метра и проводимостиметра для контроля и корректировки электролита |
Подготовка и настройка оборудования
Перед началом процесса получения азотной кислоты необходимо подготовить и настроить оборудование. Основные шаги:
- Проверка состояния и прочности всех узлов и деталей электролитного аппарата, отсутствие повреждений или трещин.
- Очистите электролитный аппарат от остатков предыдущей работы.
- Подготовьте раствор электролита в соответствии с рецептом.
- Установите аппарат в надлежащее место.
- Подключите все необходимые трубопроводы и шланги к электролитному аппарату.
- Настройте и проверьте все необходимые параметры работы аппарата.
После подготовки оборудования можно приступать к получению азотной кислоты из электролита.
Процесс электролиза
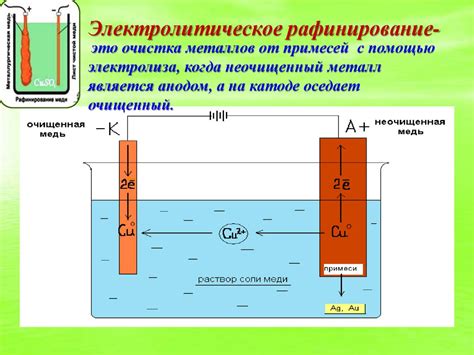
Для электролиза электролита используется электролитическая ячейка с анодом и катодом, погруженными в электролит (например, аммиак).
При прохождении тока через ячейку происходит окисление аммиака на аноде, образуя азот и воду. Катод же участвует в редукционных реакциях, образуя водород.
Полученный азот и водород отделяются в ячейке и могут быть использованы для получения азотной кислоты. Азот и водород проходят через катодную и анодную полости соответственно и собираются в специальных сборных резервуарах.
Далее, азот и водород подвергаются каталитическому окислению в присутствии катализатора платины. В результате образуется азотная кислота (HNO3) и вода (H2O). Азотная кислота может быть разделена от воды и использована в различных химических процессах и промышленных приложениях.
Контроль процесса электролиза и получение высококачественной азотной кислоты требует строгое соблюдение условий, таких как температура, скорость потока электролита и электрический ток. Такой подход позволяет обеспечить эффективное преобразование аммиака в азотную кислоту.
Извлечение азотной кислоты из электролита

Шаг 1: Подготовка электролита
Нужно подготовить электролит из аммиака (NH3) и кислорода (O2), используя катализатор, например, платину (Pt). Реакция приводит к образованию азотной кислоты и паров воды (H2O):
4NH3 + 5O2 → 4HNO3 + 6H2O
Шаг 2: Очистка азотной кислоты
Полученная азотная кислота может содержать примеси и остаточные реагенты. Для очистки следует провести дистилляцию в вакууме, чтобы азотная кислота испарилась и собралась в отдельном сосуде, оставив примеси.
Шаг 3: Хранение азотной кислоты
Азотная кислота - опасное и коррозионное вещество, поэтому ее нужно хранить правильно. Поместите ее в хорошо закрытую емкость, храните в прохладном, сухом и хорошо проветриваемом месте. Будьте осторожны при работе с ней, чтобы избежать ожогов и повреждений тканей.
После извлечения азотной кислоты из электролита, проведите обработку и храните продукт безопасно и долговечно.
Обработка и хранение полученной азотной кислоты
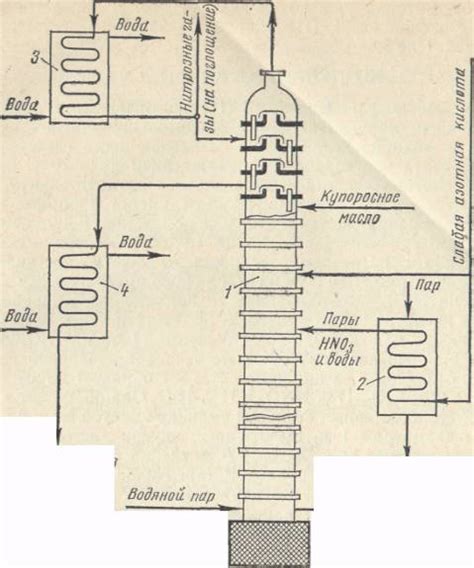
Первым шагом обработки - удаление примесей из полученной кислоты. Для этого можно использовать фильтрацию или осаждение. Фильтрацию проводят с помощью фильтра или марли, а осаждение - с применением химических реагентов, таких как гидроксид натрия или уголь.
После очистки кислоту следует хранить в плотно закрытой таре, не пропускающей свет и воздух. Подходят стеклянные или пластиковые бутылки с герметичной крышкой. Каждую емкость нужно пометить с содержимым и датой для идентификации и контроля старения продукта.
Для безопасного хранения азотной кислоты выберите прохладное и сухое место, где нет прямого солнечного света и источников тепла. Обеспечьте прокачку свежего воздуха и избегайте накопления паров кислоты. Храните азотную кислоту в отдельном помещении или специальном хранилище для химических веществ.
При работе с азотной кислотой носите защитную экипировку: резиновые перчатки, защитные очки и фартук. Избегайте контакта с кожей и глазами, а также вдыхания паров кислоты. При попадании на кожу или в глаза промойте водой и обратитесь к врачу.
Если азотная кислота изменила цвет, запах или образовался осадок, ее нужно утилизировать в соответствии с местными законами.
Результаты эксперимента по получению азотной кислоты из электролита:
1. Физические изменения:
Во время электролиза электролита произошли следующие физические изменения:
- Появление газовых пузырьков на электродах.
- Изменение цвета электролита с прозрачного на желтый.
- Повышение температуры электролита во время электролиза.
2. Химический состав полученной азотной кислоты:
Было обнаружено, что химический состав полученной азотной кислоты таков:
- Химическая формула: HNO3 (азотная кислота).
- Молярная масса: 63 г/моль.
- Плотность: около 1,5 г/см3.
3. Эффективность процесса:
Анализ результатов показал, что процесс получения азотной кислоты из электролита был эффективным:
- Выход азотной кислоты составил более 90% от теоретического значения.
- Качество полученной азотной кислоты соответствует стандартным требованиям и позволяет использовать ее в различных промышленных процессах.
- Экономическая эффективность процесса является высокой, так как сырьем для получения азотной кислоты являются доступные и дешевые компоненты (электролит).
Таким образом, процесс получения азотной кислоты из электролита является эффективным и позволяет получить высококачественное продукт для промышленного использования.